
올해 연말 발효를 앞두고 있는 미국 ‘화장품 규제 현대화법’(The Modernization of Cosmetics Regulation Act of 2022· 이하 MoCRA)과 관련해 이어지고 있는 미국 FDA의 후속조치의 강도가 예상을 넘어서는 수준에 이르고 있다.
미국 FDA가 지난 15일자로 발표한 ‘Draft Cosmetics Direct Electronic Submissions Portal’이라는 제목의 문서에는 화장품 제조기업과 브랜드사가 MoCRA 서류 제출 시스템 오픈 이전에 세부 내용을 꼼꼼하게 확인해야 할 규정(조항)들이 곳곳에 존재하고 있다는 것이다.
<파일 원문 바로가기: https://www.fda.gov/media/171557/download?attachment >
지난 두 차례에 걸쳐 MoCRA 시행과 관련한 기고문을 게재한 바 있는 홍정훈 리소스오브케이뷰티 대표는 “FDA가 발표한 가장 최근(9월 15일) 문서에서 지금까지 확인해 왔던 주요 방침들보다 강화한 내용들을 발견했고 이는 국내 화장품 기업들에게 당초의 예상을 뛰어넘는 영향을 미칠 가능성이 높다”고 지적했다.
우선 제조기업(Facility) 등록시 시설에서 제조 또는 가공된 화장품의 시판중인 모든 브랜드 이름을 등록해야 한다는 사실이다.

홍 대표는 “여기서 중요한 부분은 ‘모든 브랜드’라는 점이다. 단지 미국으로 수출하는 제품 뿐만 아니라 제조기업이 생산하고 있는 모든 브랜드 제품의 정보(브랜드 이름·RP 이름·해당 브랜드의 제품 카테고리 등)를 등록해야 할 것으로 보인다”며 “이는 제조기업의 처지에서는 대단히 큰 부담으로 작용할 수 있다”는 해석을 내놨다.
그는 “MoCRA 법안과 이후 발표한 가이던스에는 ‘미국으로 수출하는’ 또는 ‘미국으로 유통하는’ 표현을 포함하고 있었다”고 전제하고 “그러나 제조기업이 기입해야 하는 브랜드 정보에는 ‘미국으로 수출하는’ 표현이 없고 대신 ‘All brand’라고 명시했다. 이를 토대로 판단해 볼 때 제조기업이 생산하는 브랜드 제품은 미국 수출 여부와 관계없이 모두 등록을 해야 할 상황까지 확대 가능성이 크다”고 덧붙였다.
홍 대표의 이러한 예상은 최근 들어 미국으로 정식 수출을 하지 않아도 ‘목록 통관’ 또는 ‘역직구’ 방식으로 미국 내 판매가 이뤄지는 제품이 많다는 현실을 반영, 앞으로 FDA가 이같은 제품에도 규제를 확대·적용하겠다는 방침으로 해석할 수 있다는 데 기반하고 있다.
두 번째 사안은 기업·제품 등록 과정에서 서명을 요구하는 조항과 이 서명의 심각성(법적 제재 가능성)에 대한 부분이다.
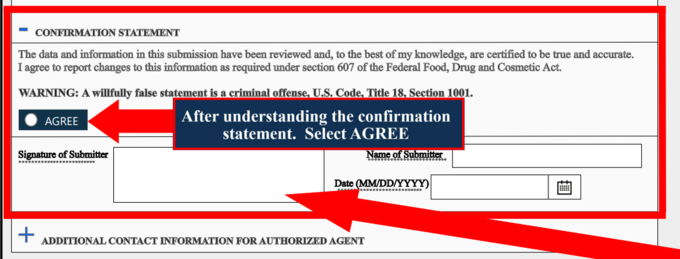
이 서명 페이지의 ‘Statement’와 ‘Warning’의 원문과 이를 번역한 내용은 다음과 같다.
‘Statement: The data and information in this submission have been reviewed and, to the best of my knowledge, are certified to be true and accurate. I agree to report changes to this information as required under section 607 of the Federal Food, Drug and Cosmetic Act.’
‘진술: 이 제출물의 데이터와 정보는 검토가 이뤄졌으며 저(제출인)의 지식으로는 정확하고 거짓이 없음을 인증합니다. ’연방식품·의약품·화장품법 제 607조에 따라 이 정보에 대한 변경을 보고하는 데 동의합니다.‘
‘Warning : A willfully false statement is a criminal offense, U.S. Code. Title 18, 1001.’
‘경고: 고의로 한 거짓 진술은 미국 형법 제 18조, 1001조에 따른 형사죄입니다.’
관련해 홍 대표는 “FDA는 기업·제품 등록과정에서 발생할 수 있는, 고의로 제출한 거짓 정보에 대해 엄중한 책임을 물을 것이 자명하다”며 “과거 VCRP 시스템과 FDA·CDER·OTC 등록 과정에서 허위 정보를 제출한 사례도 있었지만 앞으로 FDA는 이러한 부분들에 대해 법적 책임을 묻겠다는 방침을 명시하고 나선 것”이라고 해석했다.
세 번째로는 ‘FEI 번호 확보의 시급성’이다.
제조기업 등록 과정에서 FEI 번호 입력은 필수사항이다.
홍 대표는 “FEI 번호는 MoCRA 서류 제출 시스템에 가입한다고 해서 자동 부여되는 것이 아니라 가입 이전에 FEI 번호를 할당 받아 보유하고 있어야 한다. 많은 제조기업들이 이 부분을 놓치고 있는 것으로 파악하고 있다. MoCRA 시스템의 오픈 이전에 FDA를 통해 FEI 번호를 먼저 발급받아야 한다”고 강조했다.
이어 그는 “MoCRA 시스템이 열리기 전 전 세계에서 FEI 발급 요청이 이어질 것이며 따라서 발급까지는 당초 예상보다 시간이 더 걸릴 수 있을 가능성이 높기 때문에 하루라도 빨리 FEI 번호를 확보해야 할 것”이라고 조언했다.
참고로 FEI 번호를 발급 받기 위해서는 아래와 같은 내용을 메일( feiportal@fda.hhs.gov )로 송부해 획득할 수 있다.


































